АА-амилоидозының ізашар-нәруызы қабынулық жедел фазалық сарысулық амилоидтық нәруыз — SAA болып табылады. Ол көптеген мүшелер мен тіндерден: бүйректен, бауырдан, көкбауырдан, АІЖ-нан, бүйрек үсті бездерінен табылады. Бұл кезде бүйректің зақымдалуы басым түседі. Болжамы ілкі қабынулық ауруға байланысты. Реактивті (АА) амилоидоздың себептері:
- Ревматоидты артрит.
- Басқа артропатиялар: анкилоздаушы спондилит, псориаздық артропатия.
- Созылмалы іріңді-деструктивтік аурулар (остеомиелит, бронхоэктаздар).
- Туберкулез.
- Ісіктер (бүйректік-жасушалық карцинома, лимфома).
- Отбасылық Жерорта теңіздік қызба (кезеңдік ауру).
ҚР-да АА-амилоидозының ең жиі себептерінің бірі өкпе туберкулезі болуы мүмкін. Туберкулезбен сырқат науқастардың өмір ұзақтығының ұлғаюына байланысты туберкулездің амилоидозбен асқынуының пайыздық көрсеткіші артуы ықтимал. Кей жағдайларда амилоидоз белсенді емес немесе емделген өкпе туберкулезімен, бірақ айқын пневмосклерозы, эмфиземасы бар науқастарда дамиды. Амилоидоздың дамуында басқа аурулардың ішінде өкпедегі және басқа мүшелердегі іріңді үдерістер (бронхоэктаздық ауру, өкпе абсцесі, остеомиелит және т.б.) маңызды орын алады. Сондай-ақ, амилоидоздың дамуында ревматоидты артриттің айтарлықтай маңызы бар.
Бүйректің АА-амилоидозының ерекше түрі кезеңдік ауруы бар науқастарда дамиды. АА амилоидозының патогенезі бір-біріне ұқсамайтын бірнеше факторларға байланысты. Ізашар-нәруыздар. Фибриллярлық АА нәруызының ізашары — сарысулық амилоидтық нәруыз болып табылады (SAA). SAA гені адамда 11 хромосомада орналасқан. SAA нәруыздары екі топқа бөлінетін гомологиялық нәруыздар тұқымдасына жатады. Бірінші топқа бауырда өндірілетін жедел фазалық І типті нәруыздар — SAA1 және SAA2 (SAA1+2) жатады. Жедел фазалық реакциялар кезінде сарысудағы SAA1+2 концентрациясы 1–2 mg/ml концентрациясына жету үшін 1000 есеге дейін дерлік артуы тиіс. Олардың 80%-ы жоғары тығыздықты липопротеиндердің (ЖТЛ) 90%-ынан тұратын липопротеиндермен байланысты. SAA нәруыздарының екінші тобы (адамда SAA4, тышқандарда SAA3) үнемі экспрессияланып отырады және олардың плазмадағы концентрациясы 55 mg/ml шамасында болады; адамда SAA4 түрлі мүшелер мен тіндерде өндіріледі және де ол жедел фазалық нәруызға жатпайды.
Жедел фазалық жауап. АА амилоидозының ұзақ уақытқа созылған қабыну және/немесе инфекциялық аурудан кейін дамитындығы белгілі. АА амилоидозы жедел фазалық жауап болмаса немесе сарысулық SAA нәруызының деңгейі жоғарыламаған жағдайда дамымайды. Жедел фазалық SAA-ң синтезі мен секрециясынацитокиндер, негізінен интерлейкиндер (IL-1, IL-6) және ісік некрозының факторы (TNF) ықпал етеді. Мезотелиома, Ходжкин ауруы, саркоидоз сияқты қатерлі аурулар кезінде кездесетін АА амилоидын ісіктік немесе гистиоциттік жасушалар өндіретін және бөлетін цитокиндер өршітуі мүмкін. Цитокиндер жүйелік жедел фазалық жауапты туындатады және SAA өндірілуін күшейтеді, бұл АА амилоидозының дамуына әкеледі. SAA-ның ілкі құрылымы оның фибриллярлық нәруыздарды түзу қабілетіне әсер етеді.
Адамда амин қышқылдарының амилоидозбен арнайы реттілігінің байланысы әзірше дәлелденбеген, бірақ аурудың даму жиілігіне генотиптің әсер ететіндігі анықталған. SAA1.3 генотипі ревматоидты артритпен зардап шегетін, бірақ амилоидозсыз науқастарға қарағанда, АА амилоидозымен ауыратын науқастарда жиірек кездеседі. Аполипопротеиндердің, липопротеиндердің метаболизмі мен амилоид түзілуінің арасында байланыстың бар екендігін амилоидтық депозиттердің алдымен липидтік және холестериндік метаболизмнің негізгі орындары болып табылатын (бауыр мен көкбауыр) мүшелер мен тіндерде пайда болуы дәлелдейді. SАР компоненті осы кезде белгілі барлық амилоидтық аурулардағы депозиттерден табылған.
SАР пентраксиндер (pentraxin) тобына жататын N-гликозилирленген сарысулық нәруызға — сарысулық амилоидтық Р компонентіне тән және С-реактивті нәруызға ұқсас. SAP плазмада комплементтің классикалық жүйесін белсендіруге қабілетті пентамер ретінде болады. Ол бауырда өндіріледі және метаболизме ұшырайды, амилоидтық фибрилдерді және сульфаттық гликозаминогликандарды байланыстырады. SAP бүйректің гломерулалық базалдық мембранасының, терінің базалдық мембранасының, өкпенің, бауырдың, қан тамырларының және серпімді мембраналарды жауып тұратын микрофибрилдердің физиологиялық компоненті болып табылады. Бұл микрофибрилдер құрылымы жағынан амилоидтық фибриллдерге ұқсас. SAP АА амилоидозының патогенезіне былайша әсер етуі мүмкін: ол фибриллярлық нәруыздарды байланыстыра отырып, фибриллогенезді ынталандыруы мүмкін; амилоидтық фибрилдерді протеолизден қорғауы мүмкін және де ол амилоид фибрилдерінің құрылымдық компоненті бола алады. Бүйректің зақымдалуы кезіндегі амилоидоздың фибриллогенезіндегі гликозаминогликандардың және базалды мембрананың нәруыздарының рөлі талқылануда.
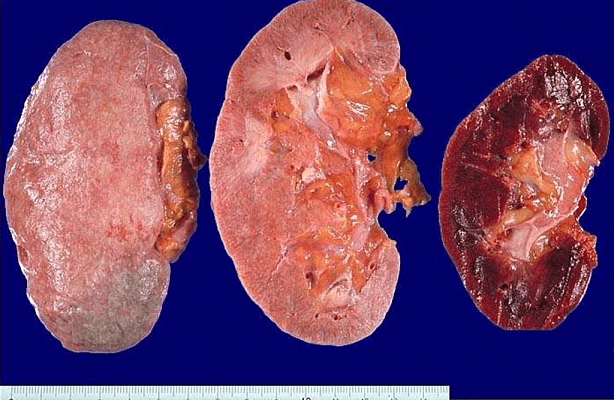
Бүйрек зақымдалуының клиникасы. Бүйрек амилоидозы маңызды мәселе болып табылады, себебі ол негізгі аурудың ағымының ауырлығын және болжамын айқындайды. Негізгі зерттеулерге зәрдің жалпы талдауы, тәуліктік протеинурияны зерттеу, бүйректің УДЗ-і (оның өлшемдері ұлғаюы мүмкін), бүйрек биопсиясы кіреді. Бүйрек амилоидозының негізгі клиникалық көрінісі — тұрақты протеинурия, оған зәрдегі нәруыздың едәуір ауытқулары (0,1-ден 3,0 г/л-ге дейін және одан жоғары) тән және микрогематурия, цилиндрурия болуы мүмкін. Нәруыздың ұзақ уақыт және айқын (3,5 г/тәул астам) жоғалуы массивті протеинурия, айқын гипо- және диспротеинемиямен жүретін нефротикалық синдромның дамуына әкеледі. СРН, холестерин деңгейі артады. Науқастардың көпшілігінде ауқымды айқын ісіктер дамиды, олар зәр айдайтын препараттарға төзімділігімен ерекшеленеді. Гипотензия тән, кейде оны бүйрек үсті бездерінің амилоидозбен зақымдалуымен байланыстырады. Үдеріске бүйрек үсті бездері қосылғанда гипонатриемия, гиперкалиемия туындауы мүмкін. Анемия және күрт жылдамдаған ЭТЖ байқалады. АА амилоидозының диагнозы, оның салыстырмалы диагностикасы бүйрек биопсиясының нәтижелеріне негізделеді.
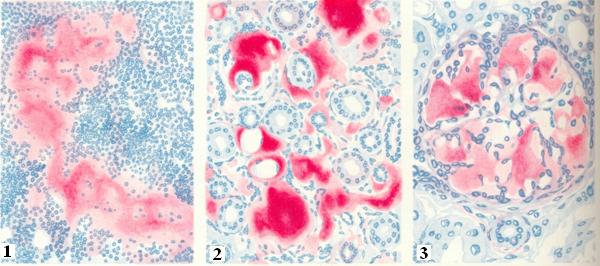
Бүйрек морфологиясы. Бүйрек зақымдалғанда амилоид шумақшаларда, негізінен экстрацелюллярлы, мезангиумде, капилляр қабырғасында, артериямен артериола қабырғасында, интерстицийде, өзекшелердің қабырғасында орналасады. Сәулелік микроскопияда амилоид конго-ротпен боялып, аморфты шөгінді ретінде көрінеді. Микроскопияда поляризацияланған жарықта сәуле сынуының қосарлануы феноменіне байланысты жасыл жарқырауды анықтайды. Т тиофлавинімен бояғанда ашық-жасыл флюоресценция анықталады. Ig-ң жеңіл, ауыр тізбектеріне иммунофлюоресцентті зерттеу теріс нәтижені көрсетеді. Электрондық микроскопияда амилоид ретсіз орналасқан фибриллдер — пішінсіз масса түрінде көрінеді. Амилоид гломерулаларға шөккенде pickups- tiks — «бір байламдағы ұзындықтары әр түрлі тіс тазартқыштар» деп аталатын көрініс береді. АА амилоидозының емі. Ем амилоидтың түзілуіне әкелген себепті жоюға бағытталған. Басты мақсат – амилоидтық нәруыздардың өндірілуін бәсеңдету. Яғни, остеомиелитте — антибиотиктер қолдану, хирургиялық ем, бронхоэктаздық ауруда — бронхоэктаздарды алып тастау және т.б. Ревматоидты артритті емдеудің маңызы зор. Цитостатиктерді (циклофосфамид, азатиоприн, хлорамбуцил, метотрексат) қолданумен қатар, қазіргі кезде ісік некрозының факторының ингибиторы (TNFα) — Remikade (infliximab) қолданылады. Реактивті амилоидозбен сырқат науқастарда аурудың болжамы бүйректің терминалды жеткіліксіздігіне байланысты болмауы мүмкін.
Амилоидоз кезіндегі бүйрек жеткіліксіздігінің тез үдеуінің себептеріне жиі негізгі аурудың өршуі, интеркуррентті инфекцияның қосылуы немесе бүйректің көктамырларының тромбозы, БЖЖ дамуы (мысалы, бүйрек үсті бездерінің амилоидозы кезінде артериялық қысымының күрт түсуі) сияқты асқынулар жатады. Бірқатар жағдайларда өлімге амилоидоздың дамуына себепкер болған негізгі аурудың өзі әкеледі. Амилоидоздың салдары түрлі асқынуларға байланысты, олар: қан құйылулар, тромбоздар, интеркуррентті инфекциялар және т.б. Диагноз аурудың бастапқы сатыларында қойылған жағдайда БСА-ның ағымы баяулайды, әрі ұзаққа созылуы мүмкін. Негізгі аурудың дер кезінде басталған белсенді емі осы патологияның ғана ағымын жақсартып қоймай, сонымен қатар, амилоидоз туындатқан бүйректің зақымдалуын да баяулатуға мүмкіндік береді. Нефропротективті ем көрсетілген. тБСЖ дамыған жағдайда науқас бүйрек алмастырушы емге көшіріледі.



